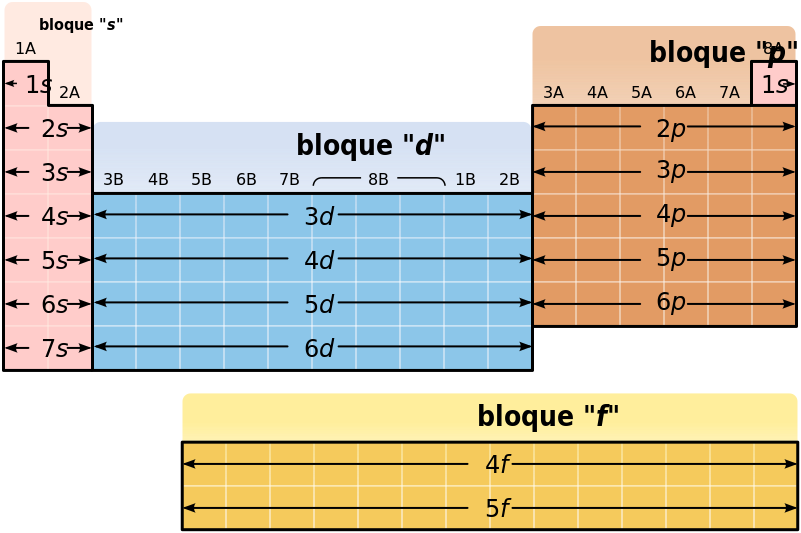
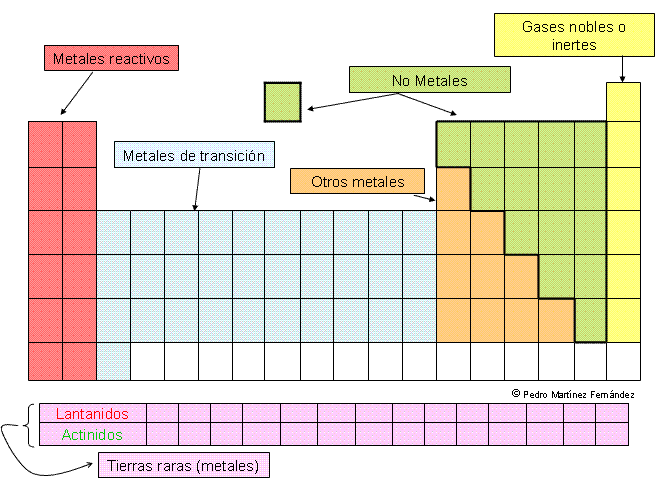
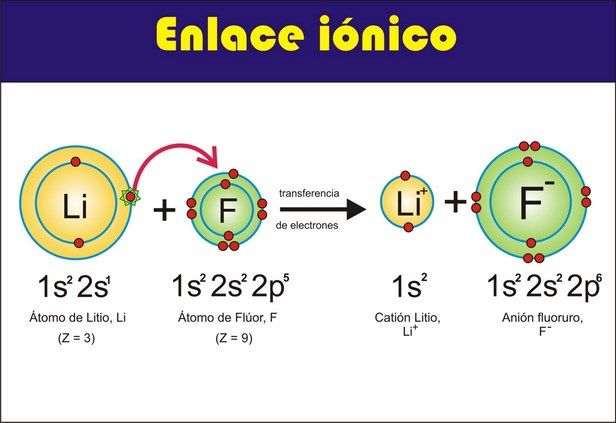
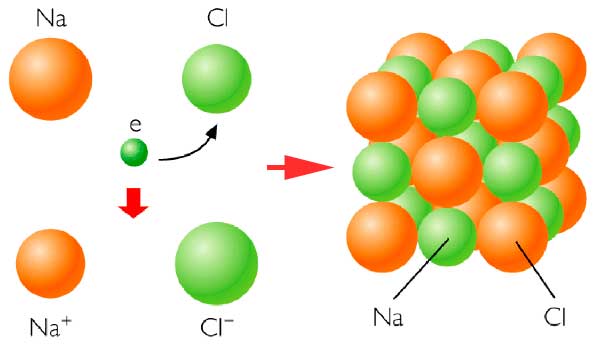
La tabla periódica de los elementos es una disposición de
los elementos químicos en forma de tabla, ordenados por su número atómico
(número de protones), por su configuración de electrones y sus propiedades
químicas.
A continuación les daremos un pequeña información a cerca de su historia.
Durante los primeros 25 años del
siglo XIX, se descubrieron unos 20 nuevos elementos. A medida que el número de
elementos conocidos aumentaba resultaron evidentes las semejanzas físicas y
químicas entre algunos de ellos. Entonces los químicos entendieron que el
estudio de las propiedades de los elementos químicos era más fácil agrupándolos
según sus propiedades semejantes en base a una ley natural.
En busca de esta ley natural
muchos químicos lograron ordenar los elementos, pero recién en 1913
Henry
Moseley descubrió el principio o ley natural que guía la clasificación moderna:
las propiedades de los elementos son funciones periódicas de sus números atómicos.
El descubrimiento de esta ley
periódica, necesitó dos acontecimientos previos:
1.-El establecimiento de una serie
de pesos atómicos consistentes y dignos de confianza
2.-La concepción del átomo nuclear
con un numero definido de protones e igual numero de electrones que giran a su
alrededor.
1. Las Triadas de Johan
Dobereiner (1817)

El químico alemán Johan
Dobereiner (1780 - 1849) agrupa los elementos hasta entonces conocidos en serie
de tres elementos llamándolo “triadas”. Los elementos que pertenecen a una
triada poseen propiedades químicas semejantes. Además el elemento central posee
un peso atómico (P.A.) aproximadamente igual a la semisuma de los P.A. de los
elementos extremos.
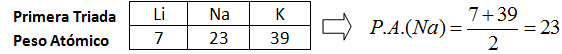
Hacia 1850, los químicos habían llegado a identificar unas
veinte triadas, Se descartó de esta forma agruparlos, porque se descubrieron
nuevos elementos que no cumplían con las triadas.
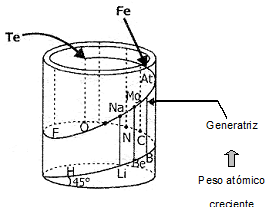
2. Ordenamiento Helicoidal o Tornillo Telúrico de
Chancourtois (1862)

Geólogo francés, propone una clasificación
periódica de los elementos en forma de hélice que llamó Caracol Telúrico. En un
cilindro trazó una hélice con un ángulo de 45° sobre la base y en ella se fue
colocando los elementos en función creciente de sus pesos atómicos, de tal
manera que la línea vertical (generatriz) del cilindro intercepta a los
elementos con propiedades semejantes.
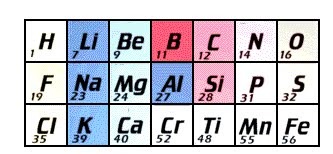
3. Ley de Las Octavas de John Newlands (1864)
El químico inglés John Alexander Reina Newlands (1838 –
1898) ordeno los elementos químicos hasta en ese entonces conocidos en grupo de
7 elementos cada uno, en función creciente a sus pesos atómicos, de tal modo
que el octavo elemento tenia propiedades semejantes al primer elemento del
grupo anterior. Esta forma de clasificar se llamó Ley de las Octavas.

Esta forma de clasificación fue ridiculizada por sus contemporáneos en la Royal Chemical Society, de tal modo que se negaron a publicar su trabajo, debido a que dicho ordenamiento no cumplía con la semejanza en propiedades para elementos con pesos atómicos altos. Sin embargo 23 años después a Newlands se le otorgó el máximo reconocimiento de la Royal Chemical Society debido a esta importante contribución al desarrollo de la ley periódica de los elementos químicos.
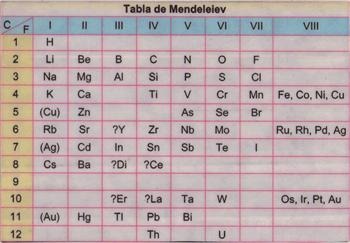
4.Tabla Periodica de Dimitri Mendeleiev y Lothar Meyer (1869)



Se denomina tabla periodica porque el ordenamiento está
basado en la variación periódica de las propiedades de los elementos.
A continuación, les presentaré una línea del tiempo para que así sea más entendible y posteriormente un video a cerca de la historia de tabla periodica junto con una animación.