¿Qué son las fuerzas intermoleculares?
Las fuerzas intermoleculares se definen como el conjunto de fuerzas atractivas y repulsivas que se producen entre las moléculas como consecuencia de la presencia o ausencia de electrones.Cuando dos o más átomos se unen mediante un enlace químico forman una molécula, los electrones que conforman la nueva molécula recorren y se concentran en la zona del átomo con mayor electronegatividad, definimos la electronegatividad como la propiedad que tienen los átomos en atraer electrones. La concentración de electrones en una zona específica de la molécula crea una carga negativa, mientras que la ausencia de los electrones crea una carga positiva.

Denominamos dipolos a las moléculas que disponen de zonas cargadas negativamente y positivamente debido a la electronegatividad y concentración de los electrones en las moléculas.
Podemos asimilar el funcionamiento de un dipolo a un imán con su polo positivo y su polo negativo, de tal forma que si acercamos otro imán el polo positivo atraerá al polo negativo y viceversa, dando como resultado una unión.

Sin embargo existen otras fuerzas intermoleculares que actúan sobre distintas moléculas o iones y que hacen que éstos se atraigan o se repelan. Estas fuerzas son las que determinan las propiedades físicas de las sustancias como, por ejemplo, el estado de agregación, el punto de fusión y de ebullición, la solubilidad, la tensión superficial, la densidad, etc.
Por lo general son fuerzas débiles pero, al ser muy numerosas, su contribución es importante. La figura inferior resume los diversos tipos de fuerzas intermoleculares.

Las fuerzas intermoleculares que actúan entre las moléculas
se clasifican en :
Dipolos permanentesDipolos inducidos
Dipolos dispersos.
Puentes de hidrógeno
Dentro de los 4 grupos descritos anteriormente, las fuerzas
más relevantes son las 3 primeras también conocidas como fuerzas de Van der
Waals.
Dipolos permanentes
Este tipo de unión se produce cuando ambas moléculas
disponen de cargas positivas y negativas, es decir son moléculas polares o que
tienen polaridad, atrayéndose electrostaticamente y formando la unión.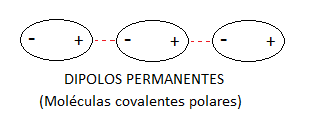

Dipolos inducidos
Este tipo de unión se produce cuando una molécula no polar
redistribuye la concentración de los electrones (tiene la posibilidad de
polarizarse) al acercarse una molécula polar, de tal forma que se crea una
unión entre ambas moléculas.
En este caso la molécula polar induce la creación de la
molécula apolar en una molécula polar.

Dipolos dispersos
Este último caso la unión se produce entre moléculas no
polares pero que pueden polarizarse, y cuando esto último ocurren se atraen
mutuamente creando la unión molecular.
La unión que se crea en este tipo de dipolos tiene una
intensidad muy débil y una vida muy corta
Las energías de unión generadas por las fuerzas
intermoleculares son muy inferiores a las energías generadas en los enlaces
químicos, pero a nivel global son superiores en número a estas últimas
desempeñando un paple vital tanto en las propiedades de adhesión como de
cohesión del adhesivo.
Van der Waals ------ 0,1 a 10 Kj/mol
Enlace Covalente ------ 250 – 400 Kj/mol.
Puente de Hidrógeno
El puente de hidrógeno es una atracción que existe entre un átomo de hidrógeno (carga positiva) con un átomo de O , N o X (halógeno) que posee un par de electrones libres (carga negativa).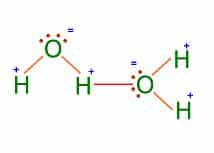

Caracteristicas
*Son muy dependientes de la temperatura, un aumento de temperatura produce un decremento de las fuerzas intermoleculares.
*Son mas débiles que los enlaces químicos, del orden de 100 veces menor
*La distancia de unión es a nivel de micras
*Las uniones no están direccionadas.
Ejemplos:
En la siguiente figura observamos un ejemplo de este tipo de interacción, entre moléculas de ácido clorhídrico.

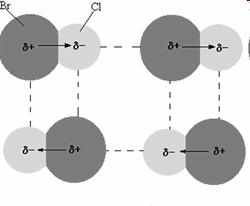
Otro ejemplo puede ser el de las moléculas de cloruro de bromo. Las interacciones dipolo-dipolo se representan con líneas punteadas.
Ahora les mostraremos un vide acerca de la fuerzas intermoleculares
Autora: Andrea Cohuo Canul
De esta informacion pude aprender que las fuerzas intermoleculares son fuerzas de atraccion entre moleculas y que tambien hay las principales fuerzas intermoleculares que son el puente de hidrogeno y las fuerzas de Van Deer Waals.
ResponderEliminar