¿Qué es el enlace iónico?
El enlace iónico es la fuerza de atracción eléctrica que
existe entre los iones de cargas o puestas (cationes – aniones) que los
mantienen juntos en una estructura cristalina.
Características:
* Son enlaces resultantes de la interacción entre los
metales de los grupos I y II y los no metales de los grupos VI y VII.
* Este enlace se produce una transferencia de electrones de
un metal a un no metal formando iones
*No forma moléculas verdaderas, existe como un agregado de
aniones (iones negativos) y cationes (iones positivos).
*Los metales ceden electrones formando cationes, los no
metales aceptan electrones formando aniones.
* Son sólidos de estructura cristalina en el sistema cúbico.
* Altos puntos de fusión y ebullición.
* Son solubles en solventes polares y aun así su solubilidad
es muy baja.
* Una vez fundidos o en solución acuosa, sí conducen la
electricidad.
* En estado sólido no conducen la electricidad. Si
utilizamos un bloque de sal como parte de un circuito en lugar del cable, el
circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como
parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en
dicho cubo, la bombilla, del extraño circuito, se encenderá . Esto se debe a
que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su
signo) de la pila del circuito y por ello este funciona.

Ejemplos:
Nitrato de calcio (Ca(NO3)2)
Óxido de magnesio (MgO) Sulfato de potasio (K2SO4)
Sulfato de cobre
(CuSO4)
Ioduro de potasio
(KI)
Hidróxido de zinc
(Zn(OH)2) Ácido sulfúrico (H2SO4)
Cloruro de sodio
(NaCl)
Nitrato de plata
(AgNO3)
Fluoruro de litio
(LiF)
Cloruro de magnesio
(MgCl2) Dicromato de potasio (K2Cr2O7)
Hidróxido de potasio
(KOH)
De igual manera, estos se pueden representar conforme a diversas estructuras:
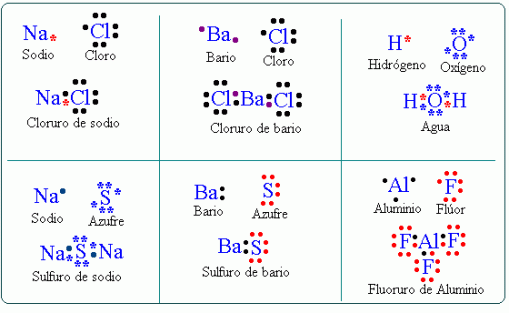


Les presentaremos un video a cerca de este tipo de enlace, para que asi la información ya dada se concrete de manera fácil y sencilla.
yo pienso que los enlaces quimicos en general son demasiado importantes ya que atravez de ellos todos lo compuestos, de igual manera tendriamos atomos libres, un ejemplo seria el enlace por puete de hidrogeno que hace que el agua no sea un gas a temperatura ambiente, si no fuera por esta atraccion entre las moleculas de agua esta herviria a temperaturas bajo cero y haria imposible la vida.
ResponderEliminar