¿Qué es el enlace covalente?
Los enlaces covalentes se definen como la unión que se
produce entre 2 átomos por la compartición de 2 o más electrones de su capa
externa con objeto de formar una molécula estable.
Un ejemplo claro es la molécula de Cloro, el cloro en estado
natural se presenta como una molécula formada por 2 átomos de cloro, dichos
átomos de cloro se encuentran unidos mediante un enlace covalente producido por
la compartición de 2 electrones.
Durante este proceso 2 átomos se han unido para formar una
molécula, obviando la teoria de los orbitales moleculares enlazantes /
antienlazantes y con objeto de explicarlo de una manera sencilla, podemos decir
que 2 orbitales atómicos (Cl + Cl) se unen para formar un nuevo orbital
molecular (Cl2).
Los orbitales se definen como las regiones de los átomos o
moléculas donde se encuentran los electrones.
Dentro de los enlaces covalentes nos encontramos con 2 tipos
de enlaces covalentes que se pueden originar:
*Enlace covalente polar
*Enlace covalente apolar
Caracteristicas:
* Temperaturas de fusión y ebullición bajas.
* En condiciones ordinales (25 °C aprox.) pueden ser
sólidos, líquidos o gaseosos
* Son blandos en estado sólido.
* Aislantes de corriente eléctrica y calor.
* Solubilidad. Las moléculas polares son solubles en
disolventes polares y las apolares son solubles en disolventes apolares
(semejante disuelve a semejante).
* Elevadas temperaturas de fusión y ebullición.
* Sólidos en condiciones ordinales.
* Son sustancias muy duras (excepto el grafito).
* Aislantes (excepto el grafito).
* Insolubles.
* Neocloridas
Enlace covalente polar
*Se origina cuando uno de los átomos dispone de mayor fuerza
de atracción de los electrones hacia su núcleo, como resultado se origina una
molécula con parte negativa y otra parte positiva (dipolo).
*Los enlaces covalentes polares siempre se producen cuando el
enlace se realiza entre 2 átomos diferentes.
*El grado de polaridad de la molécula resultante del enlace
covalente, depende de la fuerza o atracción que atrae los electrones hacia un
átomo, este concepto es definido mediante la electronegatividad.
Enlace covalente apolar
*Se produce cuando ambos átomos disponen de la misma fuerza
de atracción de los electrones hacia su mismo núcleo.
*Los enlaces covalentes apolares siempre se producen cuando
el enlace se realiza entre 2 átomos iguales o con el mismo grado de
electronegatividad.
*El concepto de molécula o material polar o apolar es de suma
importancia para el estudio de los adhesivos, por lo general aquellas
superficies que dispongan de moléculas o materiales polares en su superficie
serán óptimas para conseguir fácilmente un adhesivado duradero en el tiempo.

Ejemplos:
Sílice Bromo
Yodo Freón
Cloro Helio
Oxígeno Diesel
Agua
Dióxido de carbono
Amoníaco Glucosa
Metano Cuarzo
Propano Grafito
De igual manera, se podria reprsentar de acuerdo a la diversas estructuras, por ejemplo:
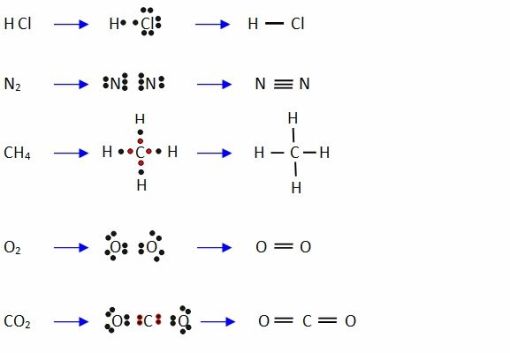

Aquí les dejamos un vide breve a cerca de los enlaces covalentes, puesto que así podrá ser más fácil de entender
Autora: Darianna Euan Tun
No hay comentarios:
Publicar un comentario